New Application Note: Purification of Oligonucleotides via IP-RP
寡核苷酸的製備級分離純化可能是一個巨大的挑戰。 IP-RP 的條件使用非常有利於開發有效的分離方法,但需要特殊的技術。 這份新的應用說明了離子對試劑通過 IP-RP 分離寡核苷酸的原理和優勢。
對於使用 IP-RP 方法純化寡核苷酸,YMC 提供了幾個非常適合的固定相。 YMC-Triart 材料提供額外的優勢,例如延長使用壽命和擴大可使用的 pH 範圍。

寡核苷酸的製備級分離純化可能是一個巨大的挑戰。 IP-RP 的條件使用非常有利於開發有效的分離方法,但需要特殊的技術。 這份新的應用說明了離子對試劑通過 IP-RP 分離寡核苷酸的原理和優勢。
對於使用 IP-RP 方法純化寡核苷酸,YMC 提供了幾個非常適合的固定相。 YMC-Triart 材料提供額外的優勢,例如延長使用壽命和擴大可使用的 pH 範圍。
使用UHPLC 方法於分析五種生物標誌物:尼古丁(nicotine)和可替寧(cotinine),以及 NNAL 以及 8-OhdG 和 m7Gua。
RP 和 HILIC 均可實現高分辨度峰型和快速分離。
尼古丁檢測中同時測定了代謝物可替寧。這裡的挑戰是,需在很短的時間內完成檢測。
NNAL,一種肺部致癌物 NNK 的分解產物,也適用同一分析條件。此外,抽菸時人類細胞也承受氧化壓力,因此典型的生物標誌物 8-OhdG和 m7Gua 也被一起評估。
請於在此處下載新的應用說明資料!

最近發表的一篇論文指南總結“如何建立穩定的 HIC 方法”。 論文重點介紹了完整蛋白質和 mAb 的分析。Eeltink 教授的小組(布魯塞爾大學/VUB)提出了有用且詳細的方面,特別是對於:
–如何設置和維護系統以實現穩定的性能
–樣品製備條件對樣品穿透的影響
–從 3 個不同的層析管柱批次中獲得的 5 隻不同層析管柱的實驗再現性
分析的樣品是完整蛋白質(intact proteins)或單株抗體(monoclonal antibodies)的混合物。 選擇的層析管柱是 YMC 的 BioPro HIC HT層析管柱。
完整文獻可免費下載!
您想了解更多關於 BioPro HIC HT層析管柱資訊嗎? 訪問我們的網站或下載 YMC BioLC 目錄。

將高性能固定相材料快速、可靠地填充進層析管柱是生產純化過程至關重要的步驟.
我們提供了精簡說明海報,針對不同的膠體、管柱類型進行說明,包括重要的注意事項和計算說明。
包含以下內容:
1.Packing Silica and Hybrid-Silica Stationary Phases into DAC Columns(請來信索取)
2.Packing Silica and Hybrid-Silica Stationary Phases into Glass Columns(請來信索取)
3.Packing of BioPro IEX Resins into Glass Columns(請來信索取)
如有純化樣品上的問題與需求或支援現場問題處理,歡迎與我們聯繫,我們將派專員與您討論。
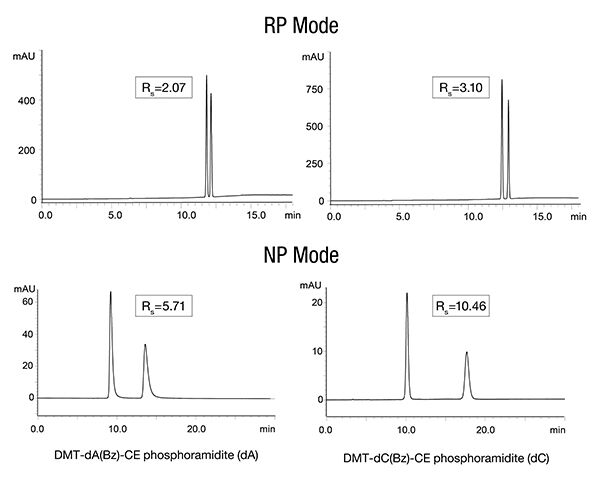
亞磷酰胺是寡核苷酸、核苷酸短片段和類似物化學合成的重要組成部分,在合成過程中可能會出現錯誤,因此需要密切監測亞磷酰胺的純度。
在本應用簡報中,說明如何使用兩種不同的分離模式分析亞磷酰胺:反相 (RP) 和正相 (NP) 管柱層析。
在此處下載相關應用資料,了解 YMC-Triart 層析管柱如何使用 RP 或 NP 分離模式得到出色的結果。
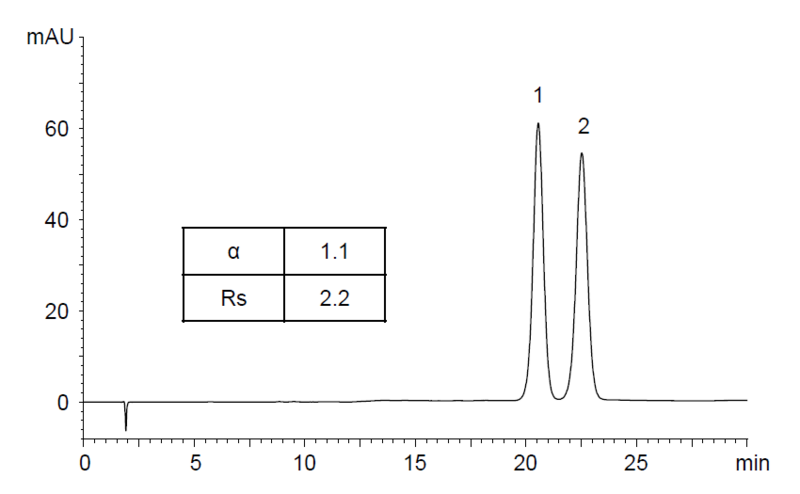
孕激素 DL-norgestrel的消旋體已上市幾年了,我們開發了針對levonorgestrel的分離。儘管levonorgestrel可以通過不對稱合成製備,但將此兩個對掌異構物的分離和/或定量仍非常重要。
此份新的應用說明如何在逆相模式下使用 YMC 的immobilised CHIRAL ART Cellulose-SC 層析管柱可靠地分離對掌異構物,且不需要非常嚴格的沖提液或樣品溶劑的要求。

HILIC 分離的沖提順序與 RP 模式完全相反,使其成為分析親水性化合物的理想選擇。由於這些化合物在 HILIC 層析管柱上沖提較晚,因此這種分離模式非常適合分析親水性生物分子。
使用 YMC-Triart SIL 層析管柱可以分離四種不同的親水性雙肽,如此份新應用說明中所示。L-Carnosine和 L-anserine可在哺乳動物的肌肉和腦組織中找到。Gly-Gly 用於胜肽合成而 Gly-Asp 常見於代謝物。
YMC-Triart SIL 層析管柱對所有雙肽均表現出出色的分離度,即使對於結構相似的化合物 L-Carnosine和 L-anserine也是如此。在此處下載應用說明副本,了解如何在 4 分鐘內完成 HILIC 分離!

進行胜肽與蛋白質HPLC分析方法最佳化時,可從以下因素切入考量:
層析管柱 |
官能團與相對應的管柱膠體孔徑大小 ⇒ 根據胜肽和蛋白質的分子量大小和疏水性來選擇最適合之組合。 一般來說,大分子樣品使用大孔徑和低表面疏水性的層析管柱。 |
|---|---|
移動相 |
梯度首選0.1% TFA/acetonitrile條件 ⇒ 如果是有各種離子特性之混合物樣品,可調整 1) TFA濃度, 2) 酸種類 以及/或pH ⇒ 調整梯度條件 較大之蛋白質使用2-propanol可能有分離效果 |
溫度 |
溫度對改變分離選擇性或改善峰形有效果。但是,可用的溫度範圍受到層析管柱耐用性之限制。 (強酸性條件+加熱會加速官能團的降解=縮短滯留時間和/或增加不利於膠體和樣品之間的二次作用力) |
<<如何選擇逆相層析管柱>> <<Bioseparation Catalog>>
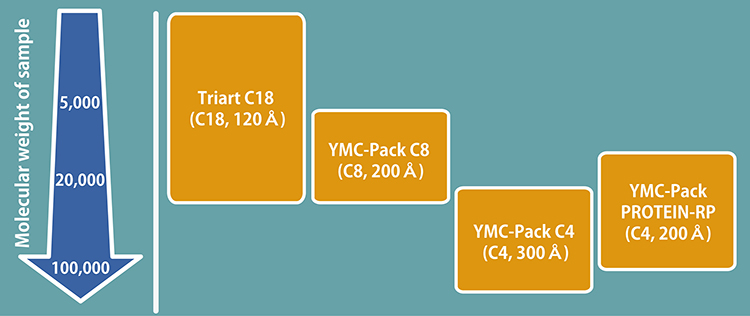
我們比較了分子量介於 4,300~17,000的蛋白質與胜肽樣品對於不同孔徑與不同官能基分離特性的比較。由以下圖譜觀察可以發現,適合這個分子量範圍的管柱為C8, 200 Å。若孔徑或是官能基選擇未進行最佳化,我們會觀察到較寬的峰型以及較差的解析度。使用適合樣品的管柱可以得到漂亮的峰型以及優越的分離結果。

1.Cytochrome c (MW 12,400)
2.Insulin (Bovine) (MW 5,700)
3.Amyloid β-protein (MW 4,300)
4.Lysozyme (MW 14,300)
5.α-Lactalbumin (MW 14,100)
6.Myoglobin (MW 17,000)
| Column | 5 μm, 150 X 4.6 mmI.D. |
|---|---|
| Eluent | A) water/TFA (100/0.1) B) acetonitrile/TFA (100/0.1) 25-60%B (0-20 min) |
| Flow rate | 1.0 mL/min |
| Temperature | 37°C |
| Detection | UV at 220 nm |
結構 (抗菌胜肽)
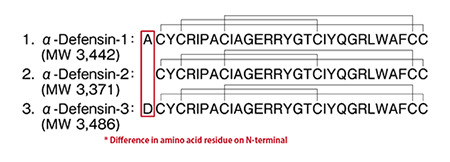
HPLC 條件
| Column | YMC-Triart C18 (1.9 μm, 120 Å), 50 X 2.0 mmI.D. |
|---|---|
| Flow rate | 0.4 mL/min |
| Detection | 220 nm |
改變管柱溫度會改變選擇性並改善峰形。高耐用性層析管柱 Triart可提供更廣泛的使用溫度範圍。 溫度控制可用作方法最佳化的工具。
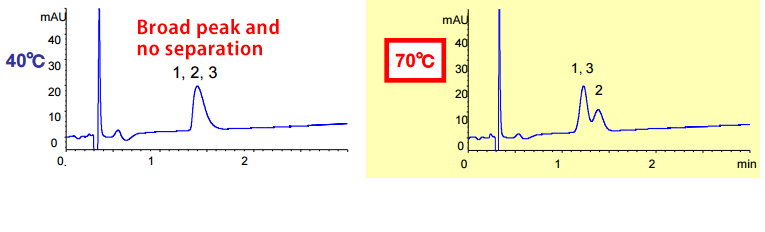
| Eluent | A) water/TFA (100/0.1) B) acetonitrile/TFA (100/0.1) 25-45%B (0-5 min) |
|---|
我們也可藉由改變酸類型和/或濃度來改變選擇性。 當化合物的離子特性差異很大時,這是一個很有效的分離策略。
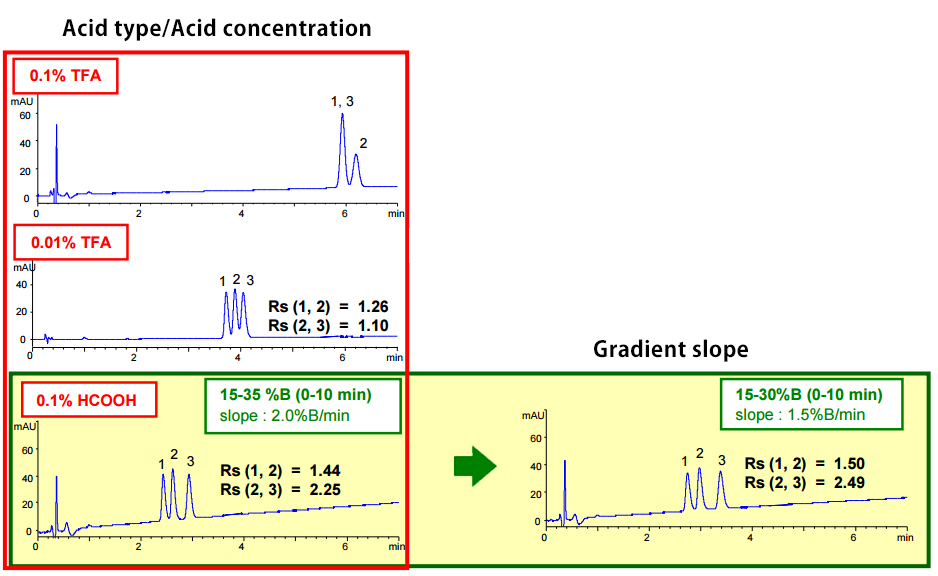
| Eluent | A) acid-containing aqueous solution B) acid-containing acetonitrile solution (0.1% HCOOH in B solution is 0.08%) |
|---|---|
| Temperature | 70°C |
2-propanol添加於移動相中並梯度最佳化。改善了peak 1及peak 2的解析度並維持一樣的分離時間。
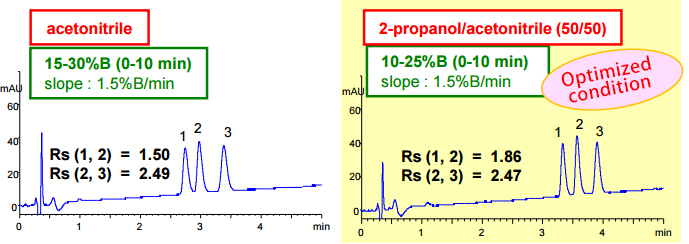
| Eluent | A) 0.1% formic acid in water B) 0.08% formic acid in organic solvent |
|---|---|
| Temperature | 70°C |

胜肽(peptides)已成為最重要的生物製藥之一。這些分子的廣泛功能提供了多種藥物的應用。胜肽的化學性質取決於肽鏈的長度、胺基酸側鏈的組成以及分子的潛在二級結構和修飾。
因此,胜肽的大小和物理化學性質可能有很大的不同。這導致生產和製備純化的特殊要求。因此,必須找到最合適的純化策略來解決因此而產生的各種不純物組成。
儘管胜肽分子的生產來源為—合成(synthesis)或重組(recombinant)—藉用逆相層析進行純化是最常使用的,因為可以很容易地分離胜肽的結構變體(structural variants)甚至較小的胜肽中單個胺基酸差異。本文件是在考量經濟效益和生產方面的情形下發表此開發製備型胜肽純化策略指南。這意味著:在成本限制之下於最短循環時間內達到最大的樣品回收率。著重於將毫克級放大到克級產量,而生產規模可達到公斤級甚至噸級產量。製備級LC全面的方法開發通常是以線性放大方法計算,它包括以下步驟:
1.分析級方法開發
2.分析級進樣量測試
3.放大至製備級純化
4.法規事務支援
YMC提供了各種不同材質(C18, C8, C4…等)、粒徑(50~10µm, 7µm…等)、孔徑大小,協助客戶各種不同方法條件篩選,甚至可應用於全水相以及鹼性條件的應用。詳細內容請來信與我們討論或索取原文說明資料。
原文出處:Strategic peptide purification by YMC EUROPE(請來信索取)
相關應用資料:
Peptide純化放大案例應用資料(以Liraglutide為例)(請來信索取)
Application of amino acids/peptide/protein如未列出您所需要分析物,請來信與我們討論取得最新應用!
連續式純化胜肽生產,案例說明tetracosactide,歡迎至我們的客戶BACHEM發佈的youtube影片連結了解詳情(如影片連結失效,請與我們聯繫)。
另有Liraglutide 連續式純化MCSGP應用,請來信與我們討論取得最新應用!

我們新增了莫奈拉韋(Molnupiravir)與大麻素(Cannabinoids)HPLC分析方法!
應用資料如下:
莫奈拉韋(Molnupiravir)
大麻素(Cannabinoids)
使用管柱為YMC-Triart C18
近期留言